安全性情報管理
臨床試験・市販後における安全性情報の評価・報告等を
経験豊かなスタッフが支援します
 インテリムの安全性情報管理サービス
インテリムの安全性情報管理サービス
治験・市販後における副作用症例、文献、外国措置情報等の国内外安全性情報について一次評価・PMDA報告書(案)作成を、経験豊かな専門スタッフが行います。
また、海外提携企業向けに国内症例の英訳と報告(案)作成をタイムリーに行います。
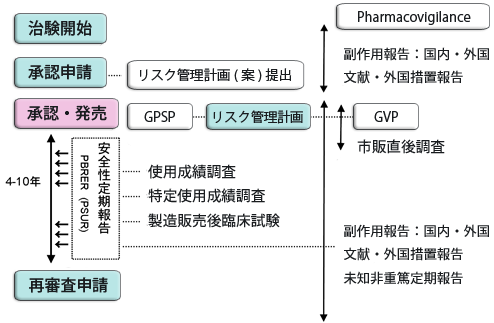
リスク管理計画、製造販売後調査等の計画、実施、安全性定期報告、そして再審査対応を支援します。
サービス内容
国内・国外の副作用症例の一次評価、PMDA報告(案)、海外報告(案)の作成
- 国内・海外の副作用(不具合)症例の入力・一次評価: 医薬品・医療機器、治験・市販後
- PMDA報告書(案)作成
- 国内症例の英訳、海外提携企業向けCIOMS等報告(案)作成
- 各種資料作成(問合せ対応、安全性評価委員会用資料(案)等)
文献・学会情報、外国措置情報の一次評価、PMDA報告(案)の作成
市販直後調査結果、定期報告(未知非重篤、感染症)用集計等
使用成績調査・特定使用成績調査の計画、実施、安全性定期報告、再審査対応
- 経験豊富なデータマネジメント、統計解析の専門家が揃っています。
- 計画、プロトコール、CRF(調査票)等の案作成業務
- 施設との契約業務も承ります。
モニタリング業務サポート: 再調査依頼書(案)作成及びモニター、MRへの指示
Pharmacovigilance、GVP、GPSP業務全般のコンサルティングその他全般業務